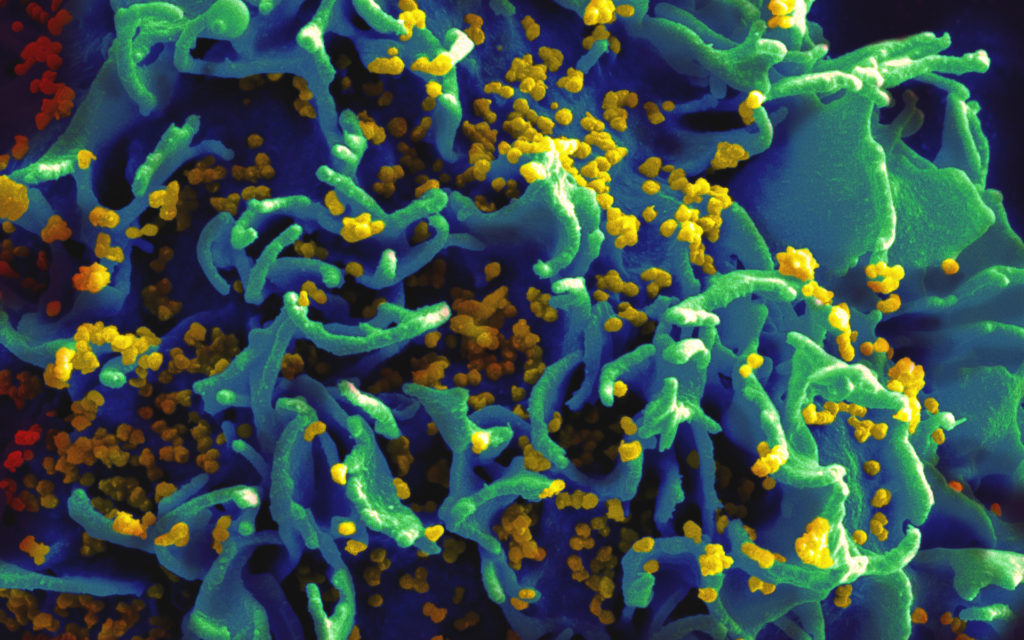
Approuvé aux États-Unis au mois de juin 2025, un nouveau médicament s’apprêterait à révolutionner la prise en charge préventive du VIH. Le lénacapavir, commercialisé par la société pharmaceutique américaine Gilead sous le nom de Yeztugo, sera injectable uniquement deux fois par an comme médicament de prophylaxie pré-exposition (PrEP).
La PrEP est prescrite aux personnes n’ayant pas été infectées par le VIH, mais étant exposées à de grands risques de l’être, comme les usagers de drogues ou les travailleuses du sexe, par exemple. Jusqu’à présent, elle était principalement prescrite sous forme de comprimés oraux à prendre quotidiennement.
Une efficacité de quasiment 100 %, peu d’effets secondaires, une fréquence d’injection très basse… Son seul défaut décrié pour l’instant serait son coût annuel, presque 30 000 dollars chez nos voisins américains.
Combien de temps pourrait mettre ce traitement si convoité à arriver en France ? Et quelle est la procédure à suivre pour qu’un médicament, ayant déjà une autorisation de marché aux États-Unis, soit approuvé dans notre pays ?
Un médicament approuvé aux États-Unis ne l’est pas automatiquement en France
Ce n’est pas parce qu’un médicament est mis sur le marché aux États-Unis, et qu’il a donc été approuvé par la Food and Drug Administration (FDA), qu’il va l’être automatiquement en France. Il devra nécessairement être validé, à nouveau, par les autorités françaises.
Il existe différentes voies possibles pour qu’un médicament obtienne cette autorisation en France et, plus largement, en Europe.
- Le médicament peut être approuvé en France par l’Agence nationale de sécurité du médicament (l’ANSM) au niveau national, uniquement.
- Le médicament peut faire l’objet d’une procédure centralisée au niveau européen. Il est donc approuvé par la Commission européenne avec une autorisation valide dans tous les États membres de l’Union européenne. Cette procédure est obligatoire pour tous les médicaments considérés comme innovant, dont fait partie le Yeztugo.
- Si le médicament a déjà été autorisé dans des États membres de l’UE, il peut faire l’objet d’une procédure dite décentralisée ou d’une reconnaissance mutuelle.
Dans certains cas, quand il y a un besoin médical urgent et qu’il s’agit d’une pathologie grave, le médicament peut recevoir un accès précoce. Cela signifie qu’en attendant l’autorisation de mise sur le marché définitive, il est approuvé plus rapidement.
Une approbation européenne accélérée pour le Yeztugo
Le Yeztugo fait partie de ces médicaments ayant reçu une évaluation accélérée. Il vient d’être approuvé par l’Agence européenne des médicaments (EMA) ce 25 juillet 2025. Il est donc autorisé dans l’Union européenne. Le site de l’EMA explique que le médicament « Yeztugo a été évalué par le CHMP, le comité de médecine humaine de l’EMA, selon un calendrier accéléré parce qu’il est considéré comme ayant un intérêt majeur de santé publique dans l’UE et dans le reste du monde ».
Il lui reste maintenant à être approuvé officiellement par la Commission européenne, phase qui prend un peu moins de deux mois généralement.
En dernier lieu, la Haute Autorité de Santé (HAS) rendra une évaluation sur le médicament pour déterminer à quel point il sera remboursé. Cette étape finale peut prendre entre quelques mois et jusqu’à 1 an.
Ainsi, en tenant compte de toutes ces procédures, on peut anticiper une mise sur le marché en France de ce médicament à partir du premier semestre 2026.
+ rapide, + pratique, + exclusif
Zéro publicité, fonctions avancées de lecture, articles résumés par l'I.A, contenus exclusifs et plus encore.
Découvrez les nombreux avantages de Numerama+.
Vous avez lu 0 articles sur Numerama ce mois-ci
Tout le monde n'a pas les moyens de payer pour l'information.
C'est pourquoi nous maintenons notre journalisme ouvert à tous.
Mais si vous le pouvez,
voici trois bonnes raisons de soutenir notre travail :
- 1 Numerama+ contribue à offrir une expérience gratuite à tous les lecteurs de Numerama.
- 2 Vous profiterez d'une lecture sans publicité, de nombreuses fonctions avancées de lecture et des contenus exclusifs.
- 3 Aider Numerama dans sa mission : comprendre le présent pour anticiper l'avenir.
Si vous croyez en un web gratuit et à une information de qualité accessible au plus grand nombre, rejoignez Numerama+.
Toute l'actu tech en un clin d'œil
Ajoutez Numerama à votre écran d'accueil et restez connectés au futur !

Pour ne rien manquer de l’actualité, suivez Numerama sur Google !











