C’est là une découverte amenée à se transformer en « de véritables traitements qui pourront améliorer la vie de milliers de personnes dans le monde », d’après les mots du co-concepteur, Grégoire Courtine. Avec Jocelyne Bloch et leurs équipes, ces scientifiques sont à l’origine d’un implant qui permet à des patients paralysés de la colonne vertébrale de pouvoir à nouveau marcher. Leur réussite vient d’être publiée sous la forme d’une étude scientifique, ce 7 février 2022, dans Nature Medecine (PDF).
L’un des patients concernés par cette avancée s’appelle Michel Roccati. En 2017, l’homme s’est retrouvé paralysé par un accident de moto, à cause d’une chaussée glissante, un jour de neige. En 2018, il entend parler des travaux de Grégoire Courtine et Jocelyne Bloch : à l’époque, les scientifiques font l’actualité en ayant permis à David Mzee, lui aussi paraplégique, de se tenir debout. Leurs recherches sont alors à leurs prémisses, et Michel Roccati prend contact avec eux pour rejoindre l’essai clinique.
Alors qu’il était paraplégique depuis son accident, Michel Roccati peut maintenant se lever, marcher, et bien plus encore. Il doit cette mobilité retrouvée à des implants qui, lors d’une procédure chirurgicale, ont été placés directement sur sa colonne vertébrale. Ils sont connectés à un logiciel. Voici comment cela fonctionne.
« Activer la moelle épinière comme le ferait naturellement le cerveau »


L’appareil développé par Jocelyne Bloch et Grégoire Courtine apporte une stimulation électrique. Des implants spinaux (placés sur la colonne vertébrale) viennent stimuler la région de la moelle épinière qui, elle-même, active les muscles du tronc et des jambes. La stimulation électrique vient donc réactiver des neurones.
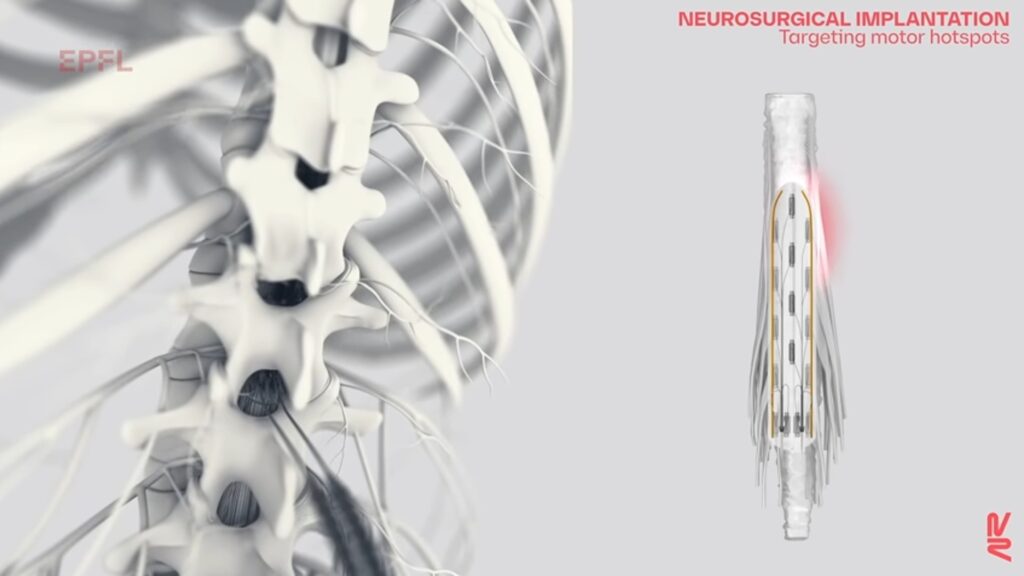
Grégoire Courtine détaille : « Nos nouvelles sondes implantées, souples, sont conçues pour être placées sous les vertèbres, directement sur la moelle épinière. Elles peuvent moduler les neurones qui régulent des groupes de muscles spécifiques. En contrôlant ces implants, nous pouvons activer la moelle épinière comme le ferait naturellement le cerveau pour que le patient se tienne debout, marche, nage ou fasse du vélo, par exemple. » Cette neurotechnologie est donc basée sur « l’imitation de la nature », en reproduisant l’activation habituelle des neurones.
Les implants sont contrôlés, à distance, par un logiciel basé sur l’intelligence artificielle. Concrètement, les patients comme comme Michel Roccati ont un déambulateur, sur lequel sont fixés deux boutons. Ils sont connectés à une tablette, sur laquelle se trouve le logiciel. Cette tablette transmet des signaux à un pacemaker, placé dans l’abdomen. Ce pacemaker relaie alors à son tour des signaux aux implants spinaux, qui, enfin, provoquent l’activation des neurones spécifiques.

L’activation du processus est contrôlé par Michel, grâce aux boutons qui servent de télécommandes. Il doit appuyer sur le bouton droit du déambulateur avec l’intention de lever sa jambe gauche ; et sur le bouton gauche avec la volonté de lever la gauche droite. À chaque fois, son pied se lève bel et bien, ce qui lui permet de marcher.
À partir de ce point de départ, Michel a suivi un entraînement intense où il devait réaliser l’opération dans différentes configurations. Par exemple, il a appris à mobiliser le système pour monter et descendre un escalier.
Le dispositif permet de retrouver de l’autonomie
L’efficacité démontrée du système ouvre « une voie réaliste » pour rétablir la mobilité chez des personnes atteintes de paraplégie. Et en effet, la récupération a démarré dès le tout premier jour d’usage du dispositif, où les patients pouvaient se tenir debout, marcher, faire du vélo, nager, contrôler les mouvements de leur tronc. Au bout de plusieurs mois, les patients avaient retrouvé de la masse musculaire et suffisamment d’autonomie pour des activités sociales autonomes (prendre un verre, debout, au bar, par exemple). L’autonomie est également favorisée par le fait que le dispositif soit petit, utilisable en dehors d’un laboratoire, et l’équipe entend pousser encore plus loin cet aspect en le faisant fonctionner sur un simple smartphone.
L’usage de l’intelligence artificielle a permis aux scientifiques de développer un programme pour chaque situation. Ils ont effectivement écrit des « programmes de stimulation spécifiques » pour « chaque type d’activité » : « Les patients peuvent sélectionner l’activité souhaitée sur la tablette, et les protocoles correspondants sont relayés au stimulateur cardiaque situé dans l’abdomen. » Il y a ainsi un programme pour le vélo, un autre pour la nage, etc.
Il demeure toutefois des obstacles sur lesquels cette équipe compte travailler. Il y a d’abord une limite au type de paralysie « éligible » : dans l’immédiat, les implants ne peuvent être fixés que chez des personnes où la lésion est dans la partie inférieure de la moelle épinière thoracique, car il faut 6 centimètres de moelle épinière « en bonne santé » pour les fixer.
+ rapide, + pratique, + exclusif
Zéro publicité, fonctions avancées de lecture, articles résumés par l'I.A, contenus exclusifs et plus encore.
Découvrez les nombreux avantages de Numerama+.
Vous avez lu 0 articles sur Numerama ce mois-ci
Tout le monde n'a pas les moyens de payer pour l'information.
C'est pourquoi nous maintenons notre journalisme ouvert à tous.
Mais si vous le pouvez,
voici trois bonnes raisons de soutenir notre travail :
- 1 Numerama+ contribue à offrir une expérience gratuite à tous les lecteurs de Numerama.
- 2 Vous profiterez d'une lecture sans publicité, de nombreuses fonctions avancées de lecture et des contenus exclusifs.
- 3 Aider Numerama dans sa mission : comprendre le présent pour anticiper l'avenir.
Si vous croyez en un web gratuit et à une information de qualité accessible au plus grand nombre, rejoignez Numerama+.
Toute l'actu tech en un clin d'œil
Ajoutez Numerama à votre écran d'accueil et restez connectés au futur !

Marre des réseaux sociaux ? Rejoignez la communauté Numerama sur WhatsApp !

















