L’intelligence artificielle va-t-elle révolutionner un pan entier de la biologie ? C’est ce qu’annonce DeepMind, filiale de Alphabet (Google), dans un billet de blog publié le 30 novembre. L’outil AlphaFold, sur lequel elle travaille depuis 4 ans, vient d’écraser une compétition entre scientifiques qu’il avait déjà dominée en 2018. Sa prouesse : parvenir à prédire avec un très haut niveau de précision le repliement de dizaines de protéines. La forme de ces molécules détermine leur fonction, et la prédire revient à mieux les comprendre.
Cette performance, si elle est confirmée par une publication scientifique, signifierait que Deepmind a résolu un problème vieux de 50 ans. AlphaFold pourrait ainsi débloquer de nouvelles perspectives dans la recherche de médicaments ou dans la gestion des déchets.
« Parmi les protéines indéterminées pourraient se trouver des fonctions nouvelles et excitantes. Les techniques comme AlphaFold pourraient nous aider à les trouver, à la manière dont les télescopes nous aident à voir plus loin dans l’univers inconnu », résument les auteurs du billet de blog
Pourquoi prédire le repliement des protéines ?
Chaque cellule humaine contient entre 20 000 et 100 000 types de protéines uniques. Et chaque protéine se compose d’acides aminés mis bout à bout — 300 en moyenne — dont l’ordre déterminera comment elle se replie. Car oui, les protéines se replient, et c’est même cette propriété qui leur permet de se distinguer les unes des autres. Un repliement peut s’effectuer entre chaque acide aminé qui compose la chaîne, ce qui mène à un nombre extrêmement grand — de l’ordre de 1 suivi de 300 zéros — de combinaisons et de structures différentes.
Problème : les protéines ratent parfois leur repliement — pour diverses raisons connues et inconnues — et en conséquence, ne remplissent plus le rôle auquel elles étaient destinées. Même si l’organisme dispose d’un système d’autorégulation — opéré par d’autres protéines —, ces défauts sont à l’origine de nombreuses maladies, comme le diabète, le syndrome de Marfan ou la maladie d’Alzheimer.
Prédire le repliement des protéines permettrait donc de mieux comprendre les maladies et de définir de nouveaux moyens de les soigner. Ce raisonnement s’applique à d’autres champs de recherche, puisque, vous vous en doutez, les cellules humaines sont loin d’être les seules structures composées de protéines.
Comment fonctionne AlphaFold
C’est donc à ce problème que s’attaque Alphafold, le logiciel de prédiction développé par DeepMind. Il se compose d’un assemblage complexe de plusieurs algorithmes, empruntés à différents champs de recherches connus sous le nom d’« intelligence artificielle ».
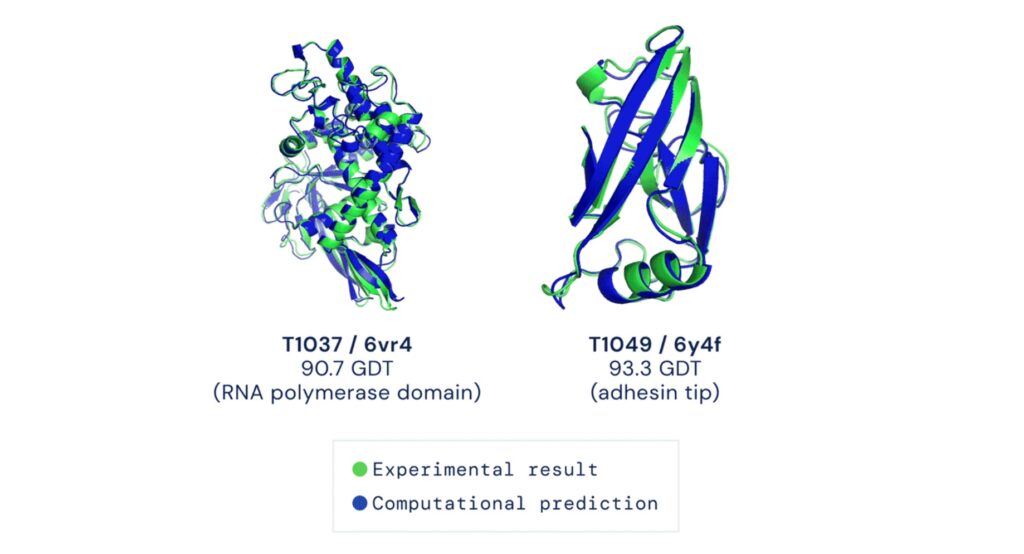
Concrètement, l’utilisateur entre une chaîne d’acides aminés dans AlphaFold et l’outil tentera de prédire comment cette chaîne se repliera. Ce résultat prend la forme d’une représentation 3D, que les chercheurs peuvent ensuite étudier.
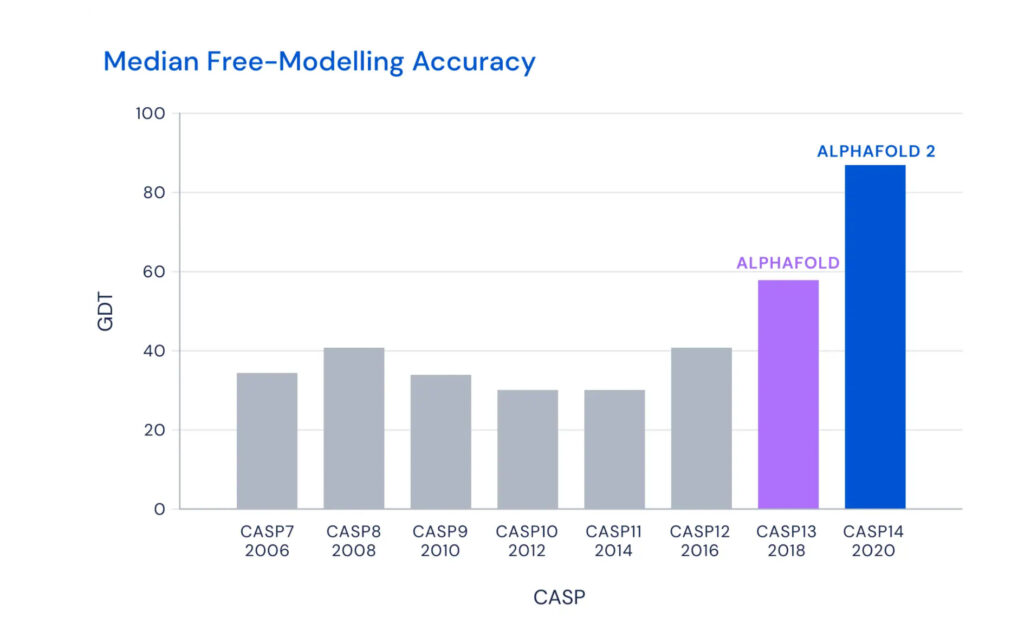
C’est ainsi qu’on en vient au Critical Assesment of Structure Prediction (CASP), la compétition remportée par AlphaFold. Lors de cet événement biennal, les meilleurs groupes de recherche mondiaux tentent de prédire les structures 3D de protéines à partir de leur composition. Les juges ont sélectionné les dernières protéines découvertes qui n’ont pas encore été rendues publiques, afin de les comparer avec les prédictions. Cette année, AlphaFold a obtenu, en moyenne, un score de précision de 92,7/100 sur ses prédictions. Soit près de 30 points de plus que lors de l’édition précédente.
Si les résultats présentés lors de la compétition sont vérifiés et validés par le processus d’édition scientifique, AlphaFold pourrait servir à découvrir de nouvelles protéines, parmi le large champ d’inconnues. « Nous connaissons plus de 200 millions de protéines, mais nous ne connaissons la forme 3D que d’une fraction d’entre elles », expliquait DeepMind dans une vidéo.
Reste que pour fonctionner, AlphaFold mobilise une puissance de calcul relativement importante. Il utilise 128 TPUv3 — les puces de Google dédiées à l’intelligence artificielle — soit l’équivalent d’environ 150 GPU, ces composants informatiques connus sous le nom de carte graphique. Et pour les protéines les plus complexes, le calcul peut durer plusieurs jours. Mais cela tombe bien, puisque DeepMind peut profiter des ressources d’un des géants mondiaux du Cloud, sa société mère Google.
Et maintenant ?
Pour commencer, DeepMind va devoir confirmer ses déclarations dans une publication évaluée par d’autres scientifiques. Ce n’est qu’ensuite que AlphaFold pourra éventuellement être exploité.
Ensuite, qui aura accès à AlphaFold ? DeepMind, rachetée par Google en 2014, avait pour objectif très élevé le développement d’une intelligence artificielle forte. Dit de façon grossière, elle veut créer une intelligence artificielle avec des capacités similaires à celles du cerveau humain. L’état de l’art est extrêmement éloigné de cet idéal, et certains doutent même qu’il soit atteignable. Résultat : pour l’instant, un seul outil développé par l’entreprise a été commercialisé par Google. Autrement dit, DeepMind coûte cher avec plus de 1 000 employés, dont des chercheurs arrachés à prix d’or à la concurrence, mais il ne rapporte rien. Une question se pointe donc à l’horizon : si AlphaFold s’avère être une innovation aussi importante qu’annoncé, Google le commercialisera-t-il ? Si oui, comment, à quel prix, et pour qui ?
+ rapide, + pratique, + exclusif
Zéro publicité, fonctions avancées de lecture, articles résumés par l'I.A, contenus exclusifs et plus encore.
Découvrez les nombreux avantages de Numerama+.
Vous avez lu 0 articles sur Numerama ce mois-ci
Tout le monde n'a pas les moyens de payer pour l'information.
C'est pourquoi nous maintenons notre journalisme ouvert à tous.
Mais si vous le pouvez,
voici trois bonnes raisons de soutenir notre travail :
- 1 Numerama+ contribue à offrir une expérience gratuite à tous les lecteurs de Numerama.
- 2 Vous profiterez d'une lecture sans publicité, de nombreuses fonctions avancées de lecture et des contenus exclusifs.
- 3 Aider Numerama dans sa mission : comprendre le présent pour anticiper l'avenir.
Si vous croyez en un web gratuit et à une information de qualité accessible au plus grand nombre, rejoignez Numerama+.
Toute l'actu tech en un clin d'œil
Ajoutez Numerama à votre écran d'accueil et restez connectés au futur !

Tous nos articles sont aussi sur notre profil Google : suivez-nous pour ne rien manquer !